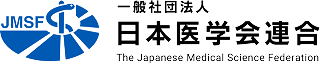5.2 新たなゲノム編集技術開発の現状
1)変異Cas9を用いたゲノム編集~ゲノム編集2.0
CRISPR系を代表とするゲノム編集技術を用いた塩基配列の改変は、Cas9と呼ばれる分子ハサミを使用して標的となるDNA配列の二本鎖を切断することから始まります。その後、細胞内にもともと備わっているDNA修復系を利用して切れたDNAが修復されます。古典的なゲノム編集技術では、切断されたDNAの修復過程を利用して、目的DNAの塩基配列を変える技術として開発・応用されてきました。これは編集効率が高く極めて有用な方法ではありますが、ランダムなindel変異の導入や染色体レベルでの欠損など、望まれないタイプの変異が意図せず導入される場合もあることが報告されています。
そこで、DNA配列を切らないタイプのCas9が開発されました。Cas9タンパク質のDNAを切る役割を持つ部分に人工的に変異を入れ、gRNAとは結合できるが標的DNAに運ばれた後にDNAを切らないように細工されています。このような変異Cas9はさまざまな用途に応用することができます。例えば、変異Cas9を酵素など別のタンパク質の機能ドメイン(何らかの機能をもっている領域)と結合し、狙ったDNA配列の近傍の領域でDNAを切断する以外の働きをさせることが可能です。この場合、Cas9-gRNA複合体は標的領域へ機能ドメインを運んでいく(集合させる)目的で使用され、実際の編集作業は変異Cas9に結合した機能ドメインが行うことになります。DNA配列の二本鎖切断を伴わないため、望まれない変異が生じにくく、より正確でかつ制御可能な編集も可能です。このような新たな編集法は「ゲノム編集2.0」と呼ばれたりしています。「ゲノム編集2.0」の代表的なツールについて、以下に紹介します。
2)DNAの二本鎖切断を介さずにゲノムを編集する技術
ゲノム編集試薬を用いて標的DNAに二本鎖切断を誘導し、細胞内にもともと備わっているDNA修復反応を利用してDNA塩基配列を改変する、ということがゲノム編集の基本ですが、DNA二本鎖切断は細胞にとって想定外の害を及ぼす可能性があることや、複数ある修復経路のうち好ましいものを選ぶことができないために必要としない変異が導入されてしまう恐れがありました。そのような背景の中、DNAに二本鎖切断を加えずに標的DNA配列を変えてしまう技術が開発されてきました。その中でも特に注目されている2つの技術、「塩基編集」と「プライム編集」について紹介します。
①塩基編集
「塩基編集」では、核酸の代謝に関連するデアミナーゼと呼ばれる脱アミノ化酵素の一部を連結した変異Cas9を使用します。これを用いると、DNAを切らずに塩基変換を行うことができます。現在、シトシン(C)をチミン(T)に変換する塩基編集酵素であるシトシンベースエディター(CBE)、アデニン(A)をグアニン(G)に変換するアデニンベースエディター(ABE)、CをGに変換するCGベースエディター(CGBE)などが開発されています。例えばCBEでは、デアミナーゼがシトシンに付いているアミノ基(-NH2)の部分を取り外し、その結果ウラシル(U)という塩基に変わります。通常はRNAに使用されるUはDNAには存在しないため、最終的にはDNAにおいてUに対応するTに置き換わることでCからTへの変換が完了します。gRNAの標的配列に対してどの部分の塩基を編集するかは、これまでに開発されてきている数ある塩基編集酵素の種類によっても異なっており、目的に応じて適切な酵素を選択する必要があります。
このように、DNAに二本鎖切断を入れないCas9を用いて標的DNA領域にデアミナーゼを集めることにより、狙った配列の塩基を変換できるため、従来の二本鎖DNA切断を引き起こすCas9と比較して、より毒性が低く正確性の高いDNA編集が期待できます。また、従来のCas9ゲノム編集技術では、病気の原因となる変異を修復するために相同組換え(HDR)による修復系を活用することが多かったのですが、HDR経路は非分裂細胞ではほとんど働かないため、非分裂期の細胞の編集は難しいといった問題点がありました。それに対して塩基編集酵素はHDR経路に依存しないため、非分裂細胞にも応用できるといった利点もあります。塩基編集技術に関しては、作物の品種改良や遺伝子治療など、幅広い分野への応用に向けた研究が進んでおり、実際にマウス等の実験動物を用いた研究では、塩基編集を用いた疾患遺伝子変異の修復およびその治療効果に関して続々報告されてきています。
②プライム編集
上述のように、塩基編集技術はDNAに二本鎖切断を入れることなくDNAの配列を変えることができますが、一塩基を置換することに特化しており、新たなDNA配列を挿入したり欠損させたりすることはできません。そのような中、DNA二本鎖切断を介さずにDNA配列に挿入や欠損を加えることが可能な「プライム編集」と呼ばれる技術が開発されました。プライム編集では、DNA二本鎖を切らないタイプの変異Cas9(実際には片方の鎖のみを切断するCas9ニッカーゼを使用します)に、機能ドメインとして逆転写酵素(RNAを鋳型としてDNAを合成する酵素です)をつなげた融合Cas9タンパク質と、通常のgRNA配列に逆転写酵素の鋳型となるRNA配列(この部分が標的DNA配列に挿入される部分となります)を付加した長めのgRNAであるprime editing gRNA (pegRNA)のセットを用います。このpegRNAの配列のうち、a) 標的DNAに相補的な配列の部分(通常のgRNAも有するpegRNAの頭の部分)と、b) DNA合成用の足場(プライマー結合配列)となる配列と編集したい配列の鋳型となる部分(pegRNAに特異的な配列でpegRNAの尻尾の部分)を自分自身でデザインして使用することになります。
それでは、プライム編集はどのような機序で新たなDNA配列の挿入や欠損を導入するのでしょうか。細胞の中でプライム編集ツールが発現すると、まず変異Cas9とpegRNAが複合体を形成します。pegRNAは標的DNA配列のところまで変異Cas9を運んでいき、DNAの片方の鎖だけ切断します。すると、切断されたDNA領域の配列と、それと相補的な配列を持つpegRNAのプライマー結合配列の部分とが結合し、逆転写酵素がpegRNAの鋳型となる部分の配列を参考にして一本鎖DNAを合成します。この新たに合成された一本鎖DNAが、標的DNAの切れ込み部分に挿入され、最終的にDNA配列の書き換えが完了します。
このように、プライム編集の作用機序は少し複雑かもしれませんが、DNA二本鎖切断が伴わないために望まれない変異の導入を回避して新たな配列の挿入や欠損を導入できる画期的な方法であるといえます。挿入できる大きさは40塩基程度までとなっていましたが、最新の報告によると、プライム編集ツールを活用し2種類のペアとなるpegRNAを用いることで、DNAドナー配列を供給することなく最大1kbもの配列の挿入をすることも可能なようです。プライム編集を応用した報告も続々と発表されており、また、実験動物では遺伝子治療への応用の成功例も報告されてきています。
3)エピゲノムを編集する技術
DNAを切らずに、またDNAの塩基配列自体は変更せずに、狙ったDNAを含む領域に何らかの編集を行う技術として「エピゲノム編集」技術があります。まずエピゲノムとは何かから説明したいと思います。
私たちの体を構成している細胞は、異なる臓器の細胞でも、同じ人であれば基本的に全てが同じゲノム(同じDNA塩基配列)を持っていますが、それぞれの臓器や組織の細胞はそれぞれ異なる遺伝子のセットを発現しています。これによって、臓器特有の機能を発揮することができるのです。
それでは、特定の臓器の細胞における遺伝子発現はどのように調節されているのでしょう。
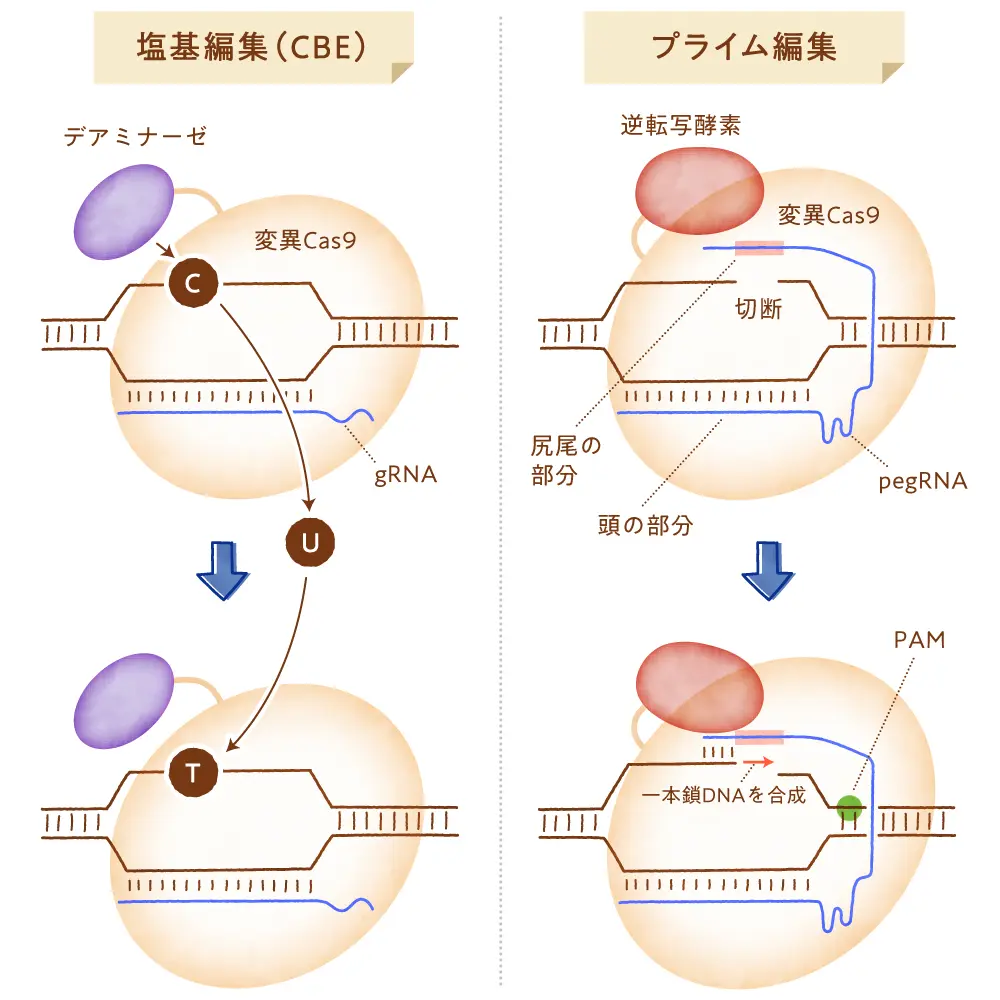
生体内には、DNA塩基配列(ゲノム)を変えることなく遺伝子の発現を調節できるシステムが備わっています。これはDNAや、または核内でDNAが巻きついているヒストンと呼ばれるタンパク質の修飾状態を変化させる(これをエピゲノム変化といいます)ことで可能となります。例えば、DNA配列の中にシトシン(C)とグアニン(G)が続けて出てくるC-Gという配列があると、そのCはメチル化という修飾を受けることがあります。またヒストンについては、ヒストンの一部のアミノ酸がアセチル化されたりメチル化されたりするなど、さまざまな修飾を受けたりします。ある遺伝子のDNA配列にメチル化された部分がたくさんあり、またそのDNAが巻きついている部分のヒストンのアセチル化が外れている(脱アセチル化といいます)と、その部分のDNAとヒストンが強く凝縮して遺伝子発現が減少します。逆に、ある遺伝子のDNA配列がメチル化されておらず、ヒストンがアセチル化されているような場合には、DNAとヒストンの凝縮が緩んで遺伝子がたくさん発現するようになります。どのゲノム領域でDNAやヒストンが修飾されるかのパターン(エピゲノムの状態)は発生の過程で細胞が分化するに従って確立されていきますが、そのエピゲノムの状態は細胞の種類によって異なるため、それぞれの細胞が特異的な特徴を持つことができるのです。
DNAの塩基配列を変えてしまう変化は一方向性(非可逆的)ですが、このようなエピゲノムの状態は可逆的であり、環境が変化することでその影響を受けてエピゲノムが変化することがあります。また、先天性の疾患やがん、精神疾患などのさまざまな疾患でエピゲノムの異常がみられることが知られています。例えばがんにおいては、エピゲノムの異常により、がんを抑制する遺伝子の発現が抑えられている場合があることが知られています。
エピゲノム編集は、このようなDNAやヒストンの修飾を人工的に調節することを可能とする方法です。エピゲノム編集では、DNAやヒストンを修飾するタンパク質の機能ドメインを連結した変異Cas9が使われます。例えば、DNAを修飾するタンパク質にはDNAメチル化酵素が、ヒストンを修飾するタンパク質にはヒストンアセチル化酵素などがありますが、これらのタンパク質が変異Cas9とつながって一緒に働くような工夫を施すことにより、gRNAの標的配列領域のDNAやヒストンの修飾状態を変化させることができます。その結果、DNAの塩基配列を変えることなく特定の遺伝子の発現を活性化したり抑制したりすることが可能となります。これを応用し、がん細胞で発現が抑えられていたがん抑制遺伝子の発現を再活性化させるなど、各種疾患の治療を目指したエピゲノム編集治療法の開発も期待されています。
4)Cas9以外のゲノム編集ツール
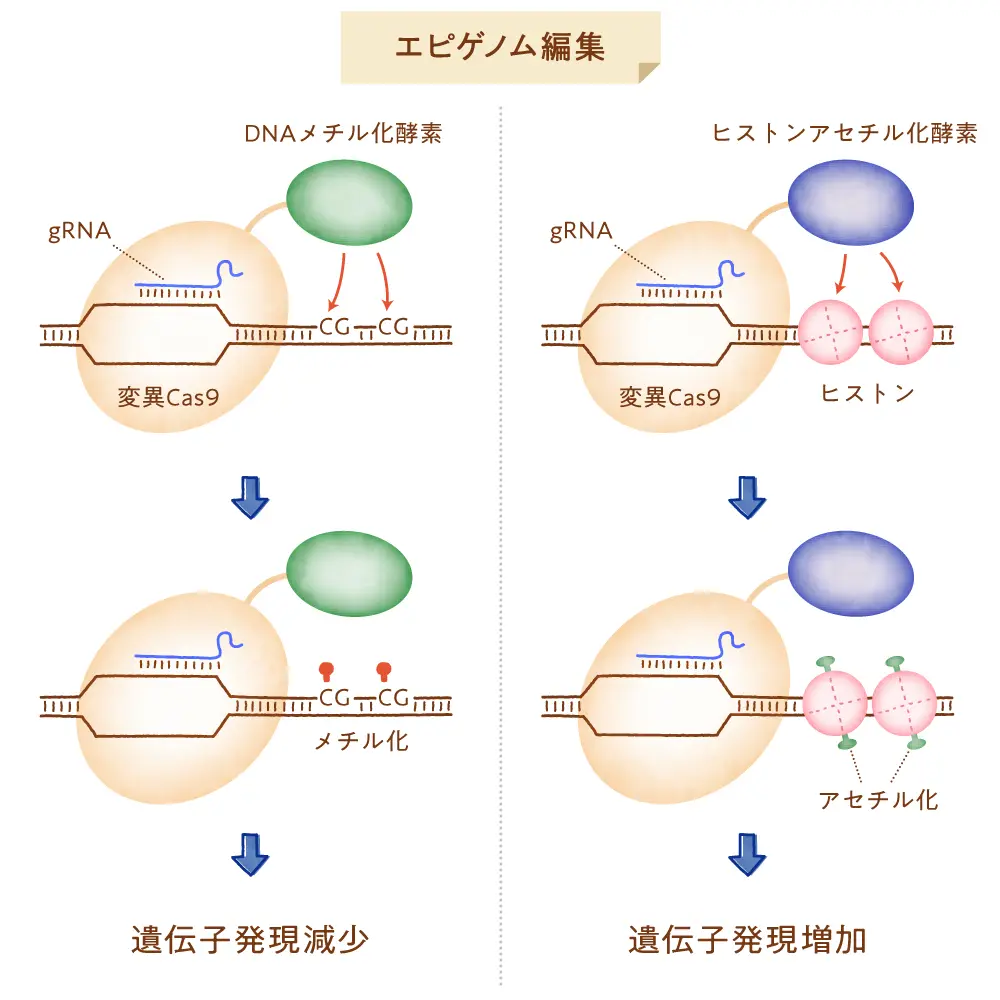
①CRISPR-Cas3システム
細菌や古細菌が持っているCRISPRシステムは、クラス2タイプIIに分類される代表的なCas9だけではなく、多種多様なものが存在することが明らかとなっています。その中でも、主にCas9やCas12aなどの一つの因子だけで機能するクラス2のCRISPRがゲノム編集ツールとして世界中で使われていました。
そのような中、日本発のゲノム編集技術としてクラス1タイプI-Eに属するCRISPR-Cas3が登場してきました。一つのタンパク質で機能が完結するクラス2のCasと比較し、複数のタンパク質が集まった複合体で機能するCas3を扱うことは少し複雑で難しそうに思われかもしれませんが、Cas3はCas9と異なる以下の2つの特徴を持っています。一つ目は、標的領域に小さな(短い配列の)変異を導入する傾向のあるCas9と異なり、Cas3は標的ゲノム領域を大きく削る特徴を有しています。数万塩基もの欠失が導入されることもあります。二つ目は、gRNAの認識配列が27塩基と長い(Cas9は20塩基)ことがあげられます。gRNAの認識配列が長いことから、それだけ特異性が高くオフターゲット作用の危険性が低い可能性が期待されます。CRISPR-Cas3技術は、ヒト疾患の原因変異の遺伝子治療や、さらにはCOVID-19診断法開発への応用も進められています。
②TiDシステム
Cas9以外のゲノム編集ツールであり、且つ日本発のゲノム編集技術であるもう一つの例にTiDシステムがあります。これはクラス1タイプI-Dに分類され、5つのCasタンパク質とgRNAが集まって機能するゲノム編集ツールです。その中のCas10dと呼ばれるタンパク質がDNAを切る活性を持っています。編集の結果として、数塩基程度の短い塩基配列の変異が誘導されるだけでなく、数kbから十数kbのDNA欠失が導入されることがあります。gRNAに認識されるDNA配列は35〜36塩基と長く特異性も高いために、オフターゲットの危険性がとても低いと考えられています。すでにヒトの細胞や植物細胞で機能することが明らかになっています。