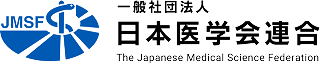3.3 ゲノム編集の医学応用の具体例
(疾患1)HIV感染症
HIVとはヒト免疫不全ウイルス(Human Immunodeficiency Virus)のことで、さまざまな細菌、カビ、ウイルスなどの病原体から守るのに重要なTリンパ球やマクロファージ(CD4陽性細胞)などに感染するウイルスです。このHIVに感染した人が、免疫能の低下によってさまざまな合併症を発症した状態を後天性免疫不全症候群(Acquired Immunodeficiency Syndrome; AIDS; エイズ)と呼びます。
HIVは血液、精液、膣分泌液、母乳などに多く分泌され、性的接触、母子感染、血液感染などによって感染します。そして免疫の仕組みの中心であるTリンパ球やマクロファージに感染し、それらの細胞を死滅させてしまいます。そのため免疫に大切な細胞が体の中から徐々に減って行き、通常はかかることのないさまざまな病気にかかりやすくなりエイズを発症することになります。HIVの治療は、複数の抗HIV薬を組み合わせて内服する多剤併用療法が中心となります。この多剤併用療法が開発されてからは、HIV感染患者の予後は飛躍的に改善しました。しかし、抗HIV薬はHIVを体内から完全に排除できる薬ではないため、一度内服を開始すればずっと飲み続けなくてはいけないうえに、抗HIV薬を中途半端に内服することでウイルスが薬に対する耐性を獲得してしまうという問題があります。
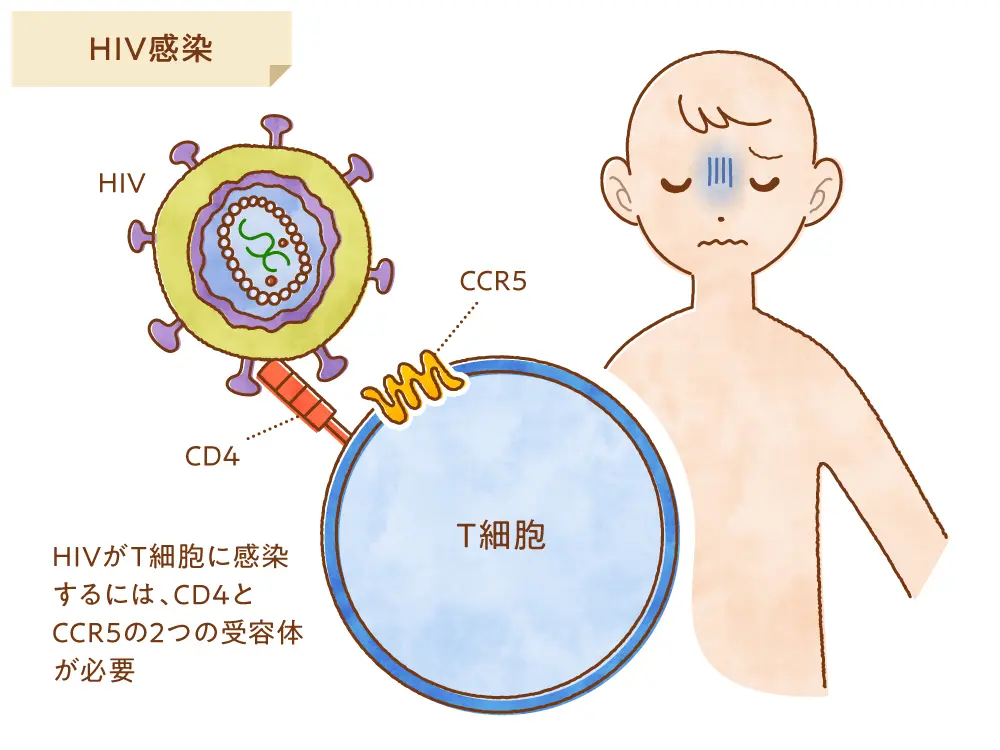
ヒトにゲノム編集技術を用いた最初の例は、このHIV患者に対するものでした。HIVがT細胞やマクロファージなどの細胞内に入りこむには、細胞表面にあるCCR5というタンパク質を必要とするのですが、ヨーロッパではごく稀に、この CCR5遺伝子が欠失している人がおり、この欠失を持つ人は HIV に感染しにくいことがすでに報告されていました。そこでHIV患者12名からT細胞を採取し、そのCCR5遺伝子にゲノム編集を加えて破壊し、遺伝子改変されたこれらのT細胞を再び患者に戻すという治療法が行われました。移植したCCR5 欠損T細胞は HIV に感染しにくいため、T細胞などが本来もつ免疫の力を維持することができ、免疫不全になりにくいと期待されます。
実際にこの臨床試験では、ゲノム編集を受けた患者の半数で症状が消えて抗HIV薬の服用が不用になりました。ゲノム編集の種類や手法を改善したさまざまな方法が試されており、ヒトでのゲノム編集治療として最も進んでいると考えられます。
(疾患2)デュシャンヌ型筋ジストロフィー
筋ジストロフィーは骨格筋や心筋などの筋肉が壊れやすく、次第に萎縮する遺伝性の難病を指します。そのうちデュシャンヌ型筋ジストロフィー(DMD)は最も頻度が高く、ほとんどが男児のみに発症する進行性の病気です。幼児期に走るのが遅い・転びやすい・立ち上がるときに膝に手を当てて立つなどの症状で気づかれ、筋力低下の進行とともに10歳前後で歩くことが困難となり、20歳ごろから呼吸不全や心不全がみられるようになります。人工呼吸器やリハビリテーションなどを行うことによって、10歳代であった生命予後が最近は30歳を超えるようになっていますが、現在のところ根本的な治療法はありません。
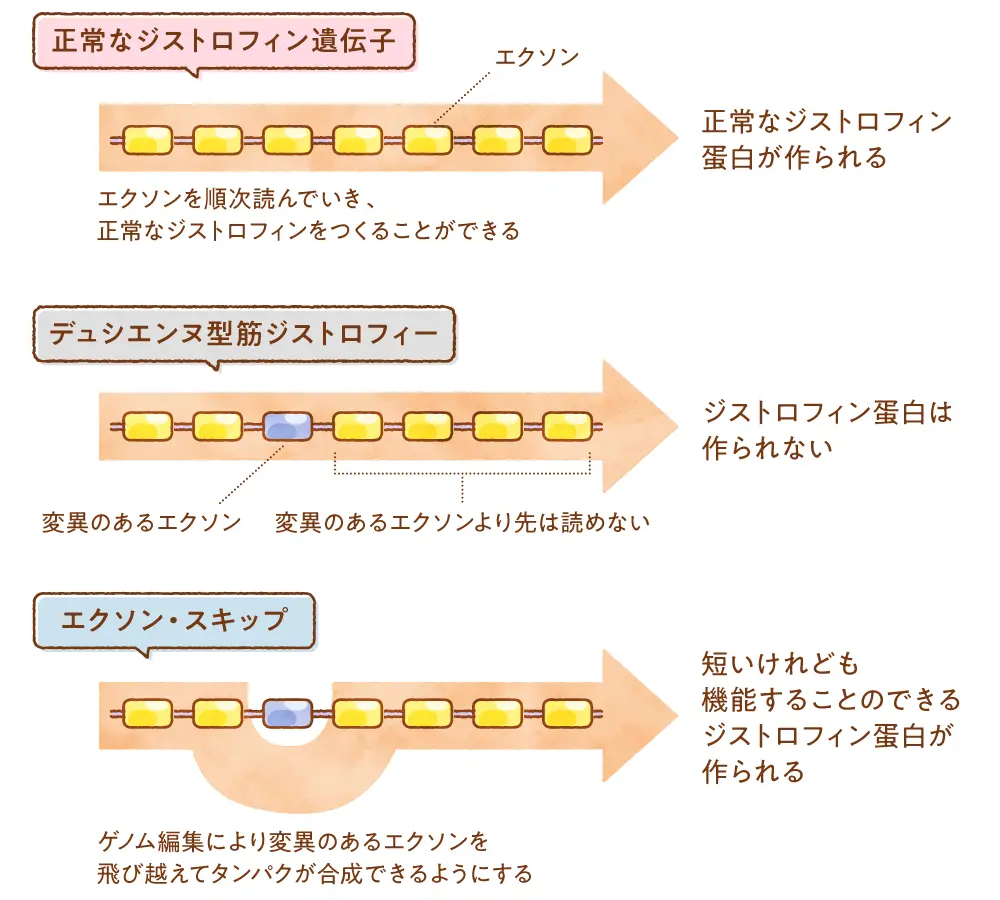
DMDの原因は、X染色体上に存在し筋細胞の膜を安定化させるのに重要な作用をもつジストロフィン遺伝子の変異にあります。ヒトの染色体(ゲノム)にある遺伝子は、「エクソン」と呼ばれる箱の部分と、その間をつなぐ「イントロン」と呼ばれる塩基配列によって構成されています。エクソンにはタンパク質を作るための情報があり、イントロンにはありません。ジストロフィン遺伝子には79の箱(エクソン)があり、それらすべての箱から情報が正確に読まれてつながれば、最終的に正常なタンパク質ができあがります。ところがDMDでは、あるエクソンに変異が起こることによって変異部分から先のエクソンからタンパク質が作られなくなっています。正常なジストロフィン蛋白が作れないために筋細胞が壊れやすく、筋力低下・筋萎縮へとつながるのです。
これまで、正常なジストロフィン遺伝子を体内に入れ患者のDNAに組み込ませるという遺伝子治療などが試みられてきましたが、ジストロフィンの遺伝子サイズが非常に大きいことなどからまだうまくいっていません。近年、このDMDに対してゲノム編集技術を用いた治療法の開発が行われています。
DMDにみられるジストロフィン遺伝子の変異は3,000種類以上見つかっていますが、それらの多くはある部分に集中しています。この変異のあるエクソンを飛び越え、後ろのエクソンからタンパク質が作られるようにすれば、(正常なジストロフィンタンパク質に比べるとその一部が短縮するものの)機能をある程度保ったジストロフィンタンパク質を作ることができます。これを「エクソンスキッピング」といいます。ゲノム編集技術を用いて、重大な変異の入ったエクソンを飛び越えることができるようにゲノムを書き換えることできれば、DMDの症状を軽減することができるでしょう。
2016年に、DMDと同じジストロフィン遺伝子の変異をもつマウスを用いてゲノム編集の治療に成功したという研究成果が複数報告されました。これらの研究では、ゲノム編集を行うためのツール(CRISPR/Cas9)を無害なアデノ随伴ウイルスに運ばせ、筋肉や血管に直接注入することで全身の筋肉に作用させました。その結果、少し機能は劣るけれども筋肉を安定化させる働きのあるジストロフィンが生成され、治療していないDMDマウスに比べて治療したマウスでは筋肉の強さが改善されました。さらに2018年には、DMDモデルである犬にゲノム編集を行い、筋肉組織におけるジストロフィン値を改善させることにも成功しています。この治療法が大型哺乳類でも効果があることが示されたことから、今後ヒトへの応用が期待されています。
(疾患3)血友病
血友病とは、血液が固まるのに必要な「凝固因子」の先天的な異常により、出血が止まりにくくなる病気を指します。ヒトの体に出血が起こると、12種類の血液凝固因子が次々と反応し、フィブリンという出血したところを塞いで固める糊のような役割をするタンパク質が作られて出血を止めようとします。しかし血友病の患者は、そのうちの一部が遺伝的に不足しているため反応が途切れ、出血が止まりにくくなります。このため幼児期以降に皮下出血や関節内出血、筋肉内出血などが繰り返し見られるようになります。ただその重症度は多様で、中には検査で偶然診断される場合も多く見られます。
血友病にはAとBの2つのタイプがあり、血友病Aでは血液凝固第VIII因子が、血友病Bでは第IX因子が不足しています。患者は通常男性で、女性は保因者(症状はないけれども血友病の赤ちゃんを出産する可能性がある女性のこと)となります。国内での患者数は、血友病Aが約5,000人、血友病Bが1,100人と言われています。
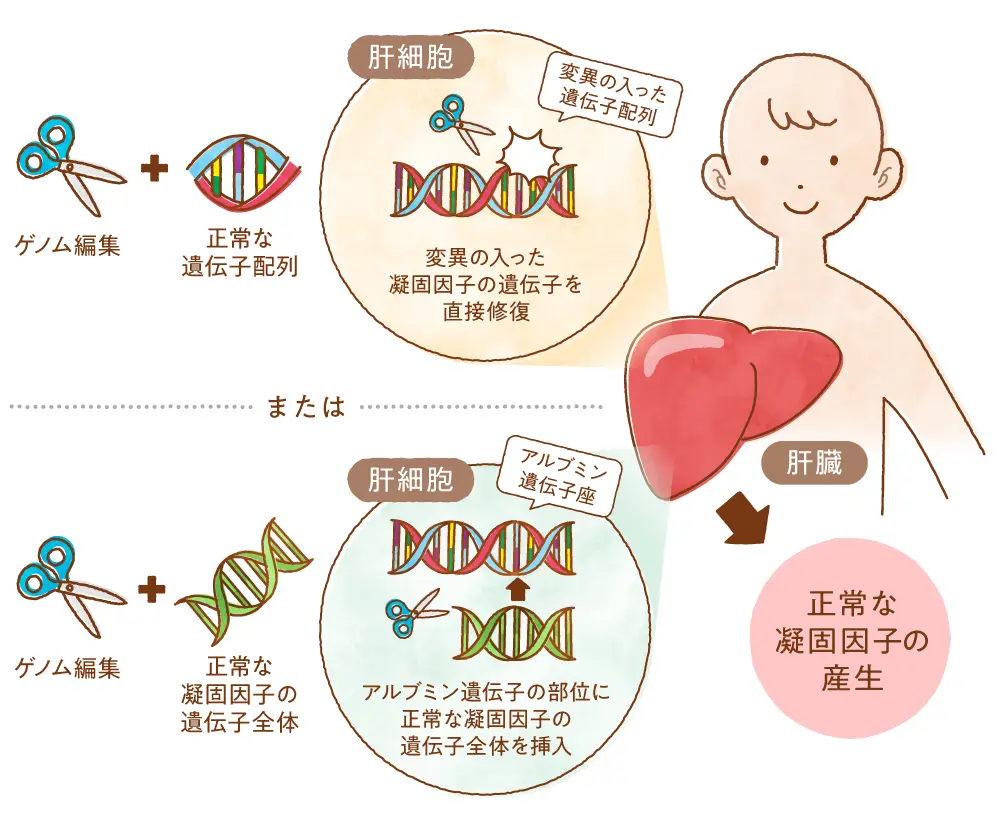
血友病の治療は、不足している血液凝固因子(血友病Aでは第VIII因子、血友病B では第IX因子)の補充が行われます。ただ凝固因子製剤の半減期は短いため、出血時に投与するだけでなく、学校活動などで出血が予想される場合に事前に注射を行ったり、また将来の血友病性関節症を避けるために定期的な補充が行われたりしています。ただこのような補充療法は根本的な治療法ではありません。患者への負担が続く上に、繰り返し補充を行うことでインヒビターと呼ばれる凝固因子の作用を弱めてしまう同種抗体が作られてしまうこともあります。そこで近年では、アデノ随伴ウイルス(AAV)を用いて正常な血液凝固因子の遺伝子を細胞内に導入し、血友病因子の産生を可能にする遺伝子治療が行われつつあります。一回の投与で長期にわたって効果が持続するなど大きな進展が見られていますが、この遺伝子治療では、肝臓の細胞が増える時期に当たる乳幼児には、細胞が分裂するにしたがって導入した正常遺伝子が徐々にうすまってしまうために効果が持続しません。そこで小児期における血友病の治癒を目指して、ゲノム編集の応用開発が行われています。
2019年に、血友病Bをもつマウスに対してゲノム編集を用いて治療を行ったという報告がなされました。血液凝固因子は肝臓の肝細胞で作られることから、遺伝子の特定の位置を切るゲノム編集のツールと、血友病の原因遺伝子異常を修復するための遺伝子配列を載せた2つのアデノ随伴ウイルス(AAV)を肝臓に投与したところ、このマウスでは血中の凝固因子が正常マウスの10~20%まで上昇しました。ヒトの場合、正常の5%程度があれば日常生活では問題がないとされていますが、このマウスでも出血が止まりにくい症状が改善されました。また生まれて間もないマウスに投与しても効果が長期間持続することが確認されており、今後のヒトへの応用が期待されています。
また海外では、肝臓で大量に作られるアルブミンというタンパク質をコードする遺伝子の部位に、ゲノム編集を用いて正常な第IX因子を組み込むという血友病Bに対するゲノム編集治療が開発され、2016年からヒトへの臨床治験が始まっています。
(疾患4)レーバー先天性黒内障10型(LCA10)
レーバー先天性黒内障は19世紀にレーバーが報告した先天性の視力障害で、小児における失明の最も一般的な原因とされています。生下時あるいは乳児期に発症し網膜機能が正常に働かず、重度の視力障害から失明にいたります。複数の原因遺伝子が見つかっていますがそのうちの一つCEP290遺伝子の変異がもたらす病態はレーバー先天性黒内障10型(LCA10)と呼ばれます。ヒトの遺伝子は「エクソン」と呼ばれる箱の部分と、その間をつなぐ「イントロン」と呼ばれる塩基配列によって構成されていますが、LCA10で見られる最も高頻度の変異は26番目のイントロン内にあり、これによってCEP290が正常に作用することができません。
米国のEditas Medicine社は、このCEP290遺伝子の変異に対してゲノム編集を行う治療法(EDIT-101)を開発しました。患者の網膜下にEDIT-101を注入することにより、原因となる遺伝子変異が除去され、正常なCEP290タンパク質が発現し、網膜機能が修復されると考えられています。2018年に初めてのCRISPR遺伝子による生体内ゲノム編集療法として米国FDA(アメリカ食品医薬品局)によって承認され、臨床試験が開始されました。2021年には第1/2相臨床試験(BRILLIANCE試験、NCT03872479)の中間解析結果として、その安全性に問題がないこと、投与された患者に視力の改善が認められたことなどが発表され、大きな期待を集めています。
(疾患5)βサラセミア、鎌状赤血球症
私たちの体は血液によってさまざまな物質が運ばれますが、とくに酸素の運搬に重要な働きをするのが赤血球の中にあるヘモグロビンというタンパク質です。成人ではヘモグロビンはαグロビン、βグロビン、ヘムという構造物から成りますが、このβグロビン遺伝子の変異または欠失により赤血球が壊れやすくなり、先天性の貧血を生じてしまいます。この病気を「βサラセミア」といいます。βサラセミアは、地中海沿岸や中東、東南アジアなどに祖先をもつ人々に多く、世界で約10万人の患者がいると考えられています。またβグロビン遺伝子にβサラセミアとは異なる変異が存在することで異常なヘモグロビンが産生され慢性の貧血に陥る「鎌状赤血球症」という病気もあります。アフリカ系の黒人に多く、重度の貧血に加えて血管閉塞による四肢の疼痛などが起こります。これらいずれの病気もβグロビンの遺伝子異常によって起こりますが、βサラセミアの患者はヘモグロビンの血液中のレベルを一定に保つために、常時輸血を行う必要があり、また鎌状赤血球症では、鎌状の赤血球が血管を塞ぐことにより、患者は激しい痛みを覚える疼痛発作に苦しめられます。現時点では造血幹細胞移植以外の根治的な治療はありませんが、いまゲノム編集を用いた治療法の開発が進められています。
胎児・新生児期の私たちの体では、成人の赤血球よりももっとたくさんの酸素を運ぶことのできる胎児ヘモグロビン(ヘモグロビンF)というタンパク質が産生されるのですが、その産生はBCL11Aという遺伝子によって抑制されています。そこでCRISPR Therapeutics社はこのBCL11Aを欠失させることのできるゲノム編集治療薬「CTX001」を開発しました。βサラセミア、鎌状赤血球症の患者の造血幹細胞を取り出し、CTX001を作用させてBCL11A遺伝子を欠失させ、ヘモグロビンFがたくさん産生されるようになった造血幹細胞を患者に移植するという方法です。
現在この治療法の臨床治験が進められていますが、2021年にはβサラセミア、鎌状赤血球症の患者計22名の経過が報告され、1回のCTX001治療によってヘモグロビン量が上昇し、βサラセミア患者全員が輸血を必要とせず、鎌状赤血球症患者全員で血管閉塞症が見られないという良好な結果が発表されています。
(疾患6)トランスサイレチンアミロイドーシス
トランスサイレチンアミロイドーシスとは、「アミロイド」と呼ばれる異常なタンパク質が全身のさまざまな臓器や組織に蓄積する「アミロイドーシス」の一つで、トランスサイレチンと呼ばれる物質の異常が原因です。トランスサイレチンは主に肝臓で作られますが、遺伝子の変異によって壊れやすくなり、その壊れたタンパク質のかたまり(アミロイド)がさまざまな臓器に蓄積します。このアミロイドが蓄積する部位によって神経症状や腎障害、心筋障害などのさまざまな症状を呈します。トランスサイレチンアミロイドーシスの患者は世界に約5万人と言われています。
Intellia Therapeutics社はゲノム編集技術によってトランスサイレチン遺伝子の欠失を誘導することのできる治療薬「NTLA-2001」を開発しました。NTLA-2001はCRISPR-Cas9タンパク質を脂質ナノ粒子と呼ばれる輸送体で内包した構造をしています。現在、家族性トランスサイレチンアミロイドーシス患者6人に対してこのNTLA-2001を静脈注射し、その効果を評価するという臨床試験が行われています。2022年に発表された中間解析結果では、安全性に問題はなく、かつ投与患者の血中トランスサイレチン濃度が平均52~87%と大きく低下したこと、単回投与でその効果が長く維持されることが報告されました。この結果は、静脈投与によるゲノム編集治療薬の誕生について大きな可能性を示したといえます。