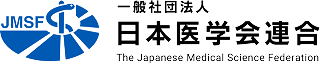2.3 ゲノム編集の応用例(治療応用を除く)
疾患病態解析
ゲノム編集は、遺伝性疾患の病態を詳しく調べるためにも利用されます。遺伝性疾患は、「遺伝子」という体を作る設計図に書かれた文字の間違い(遺伝子変異)によって起こり、それぞれの遺伝子や変異によって異なるさまざまな症状を引き起こします。変異を持つ遺伝子から作られる変異タンパク質が、細胞や体の中でどのようなメカニズムを通じて影響を与えるのかを解明するためには、実験室で細胞にゲノム編集技術を用いて遺伝子変異を導入し、その細胞の機能がどう変化するのかを解析することが役立ちます。さらに、細胞が培養されている環境(培地)にさまざまな種類の薬を加え、その機能を正常化させるための薬を探し出すことも可能となります。こうやって見つけられた治療薬の候補を、次にゲノム編集を用いて作成されたモデル動物(次の項を参照)に投与して、その効果を確かめることができるようになります。
ゲノム編集技術を用いたモデル動物の作製
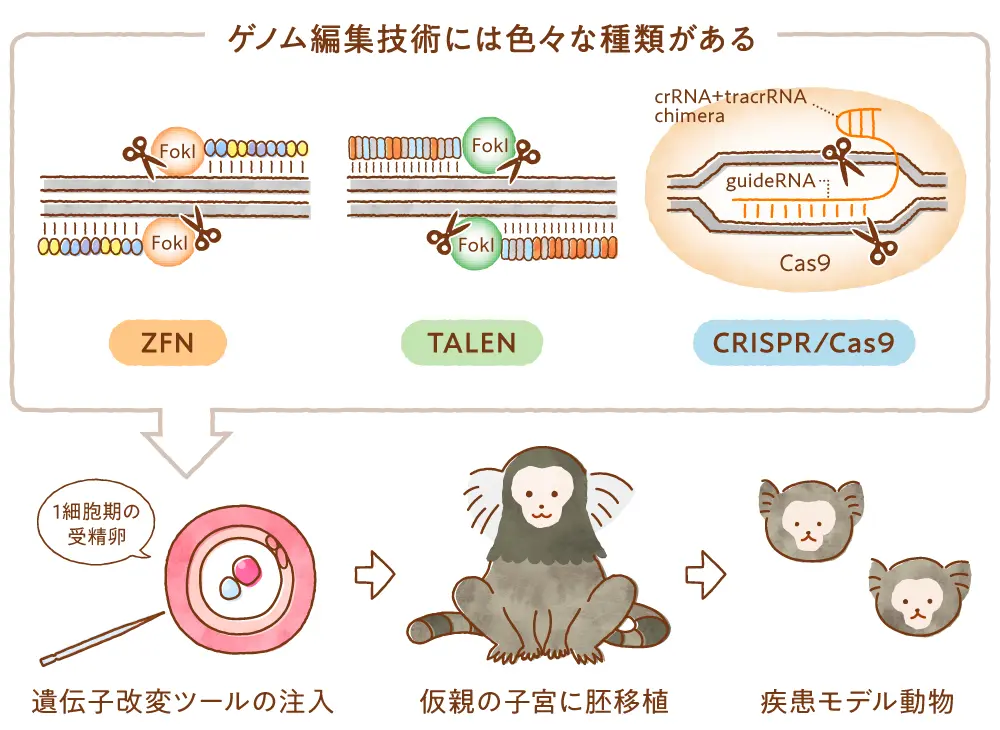
さまざまな病気に対して新たな治療法治療や薬の開発をするうえで、「治療法として有効なのか、安全なのか」という事を確認するためにマウス、ラット、ウサギ、ブタ、サルなどさまざまな実験動物が用いられています。特に治療法としての有効性の確認では、ヒトの患者と同じような病気を持つ実験動物(疾患モデル)を使って治療することで、より詳細にその効果を確かめることができます。
遺伝子改変技術の発達しているマウスでは、これまで病気の原因となる遺伝子を導入したトランスジェニックマウスや、マウスが持っている病気の原因となる遺伝子(標的遺伝子)を破壊もしくは塩基配列を変更した(遺伝子変異)、標的遺伝子ノックアウト、ノックインマウスと呼ばれる多くの疾患モデルマウスが作製されてきました。このようなモデルマウスの作製のためには、マウスの胚性幹細胞(ES細胞)または人工多能性幹細胞(iPS細胞)といった、体の全ての組織になる能力のある細胞に遺伝子変異を導入し、それをマウスの受精卵に注入して、仮親マウスの子宮に戻すことで作製されてきました。この一連の作業は複雑で、長い期間が必要でした。ゲノム編集を使うと、受精卵の遺伝子を直接変異させることができるため、簡便にモデルマウスを作製することが可能となりました。
実験動物としてマウスは多くの医学研究に貢献していますが、ヒトとマウスでは、解剖学的に異なりますし、生理学的性質や薬物代謝(薬物の体内での吸収や排泄のされ方)などで異なる点も多くあります。そのためマウスで治療効果や安全性が確かめられた新しい治療法であってもヒトでは効果がなかったり、安全でなかったりすることがありました。そこでヒトと臓器の大きさが似ているブタ、ヒトと同じ霊長類であるサルなどの実験動物を用いた検証が必要となる場合があり、ブタやサルでもマウスと同様に、疾患モデルの作製の必要性が高まっています。これまで、さまざまな動物種で病気の原因となる遺伝子を受精卵に注入して作製するトランスジェニックモデルは作られてきましたが、遺伝子変異が原因となる病気の多くでは十分に有用なモデル動物とならないという問題がありました。そこで多くの動物種においてマウスで用いられてきた遺伝子を変異させたES細胞・iPS細胞を受精卵に注入して変異遺伝子を持った仔を作る方法が試されたのですが、現在までマウス、ラットでしか成功していません。ブタやサルでもES細胞やiPS細胞は作製されているのですが、それを受精卵に注入してもマウスのように遺伝子変異を持った仔が生まれていません。
ゲノム編集技術が開発されたことで、マウス、ラット以外の動物種でもゲノム編集技術を使って受精卵の遺伝子を直接変異させることで標的遺伝子ノックアウト、ノックイン動物を作製する事が可能となりました。例えばブタでは、ゲノム編集技術を用いて糖尿病、パーキンソン病、筋ジストロフィー、免疫不全ブタなどのモデル動物が作られています。サルでは、自閉症、パーキンソン病、多発性嚢胞腎、先天性副腎低形成、免疫不全、アルツハイマー病モデルなどが作製されています。また、マウスでは、CRISPR-Cas9(2.2 ゲノム編集ってなんですか?)が使われていますが、CRISPR-Cas9は受精卵の中で遺伝子変異が起こった細胞と変異しなかった細胞が混ざった状態(モザイク状態と言います)でマウスが生まれることが多くあります。その場合、遺伝子によっては目的の病気を発症しない場合もあるため、マウスを繁殖させて、遺伝子変異を持つ細胞を均一にしていく必要があります。性成熟まで長い時間(2〜3年)がかかるサルでは、ゲノム編集を行った受精卵から生まれた個体で目的の病気を発症しないと、研究を開始するまで2〜3年待つ必要があります。そのため、モザイク状態になりにくいTALENやZFNも使われることが多くあります。CRISPR-Casに比べてTALENやZFNは人工タンパク質のデザインが少々面倒ですが、2年もかからないので、急がば回れということです。また、「5.2 新たなゲノム編集技術開発の現状」で説明されている塩基編集、プライム編集を使った疾患モデルもさまざまな動物種で作製されています。これらゲノム編集を使って作製された疾患モデルによって、今後、新たな治療法、薬、病気の早期発見法の開発が期待されます。
農作物、家畜・養殖の品種改良
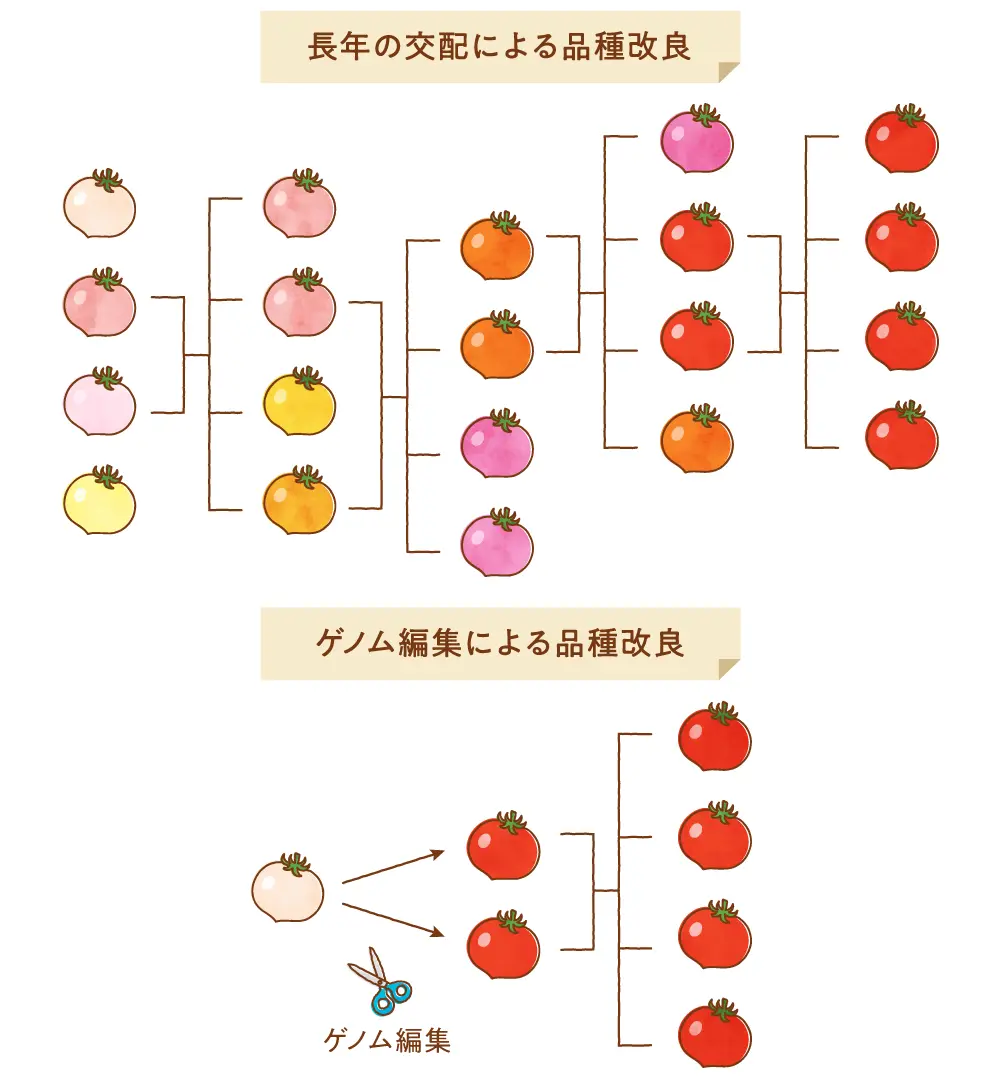
畜産や農業、養殖の分野においては、野生種をもとに、人にとって都合の良い性質を持った個体や株を選んで長年にわたって交配を繰り返し、望ましい性質を持った品種を作ってきました。例えば、野生のイノシシを長年かけて家畜化したブタや、日本人の多くが主食とするお米などが有名です。これらは交配によって作られてきていますから、もともとの動植物が持っていたDNA配列上の個体間の違い(多型)もしくは長年の間に自然に導入された突然変異の中から、望ましい性質をもたらすDNA配列が選別されて現在の品種に伝わっているものと考えられます。このような交配に基づく方法で、病気になりにくい作物や家畜の系統を樹立したり、可食部の多い品種、より美味しい品種を作っていったりすることが可能ですが、試行錯誤で臨んだ品種が得られるまでには相当の年月を要することになります。
品種改良に用いられる他の方法としては、化学物質や放射線等を用いて人工的にDNA配列に変異を導入し、偶然に得られた変異体の中から好ましい性質を持つものを選ぶ突然変異を利用した方法もあります。しかしながら、この場合も好ましい突然変異の獲得は偶然に左右されますし、同時に望まない突然変異もゲノム中のどこかに導入されたりしますので、狙った突然変異だけを選別して余計な変異を交配によって除いたりするなどの必要もあります。したがって、目的とする個体や株を得るには多くの時間や労力を要します。
それでは、もっと早く確実に目的の家畜や作物を得る方法はないでしょうか。ゲノムDNA配列を自在に改変することが可能な「ゲノム編集技術」を用いると、望んだ好ましい性質を持つ品種を、極めて短期間で開発することができるものと期待されています。ゲノム編集された生物と聞くと、人工的に加工された外来遺伝子が導入された「遺伝子組換え生物」を想像されるかもしれません。しかしながら、ここでは狙った遺伝子に二本鎖切断を誘導してランダムなindel(挿入・欠失)変異を導入する「ゲノム編集」のみについて考えます。この場合、体外で人工的に操作されたDNA配列は挿入されておらず、自然に生じうる配列のみを有する生物ということになります。このようなゲノム編集技術を応用して品種改良された動植物について、最近いくつも報告されてきていますが、ここでは、最近日本で承認されたゲノム編集トマトとマダイについて紹介したいと思います。
GABAという名前を聞いたことがあるでしょうか。GABAとは、γ-アミノ酪酸と呼ばれるアミノ酸の一種で、脳で抑制性の神経伝達物質(作用によって神経細胞の活動が低下する物質)として使われていることが知られています。血圧抑制やストレスの緩和に効果があるとして注目されている物質でもあり、食品からGABAを得ることで高血圧の予防などの健康機能効果が得られるものと期待されています。最近、このGABA含量を高めたトマト(「GABAトマト」と呼ばれています)がゲノム編集技術によって作られました。トマトでは、GADという酵素がグルタミン酸からGABAを合成することが知られています。GABAトマトは、GAD内にある酵素活性を抑制する部分(通常状態において酵素の活性中心を覆っている部分)をゲノム編集技術で除去することで作られました。酵素活性を抑制する部分がなくなってしまっているため、GADが常に活性化状態になり、たくさんのGABAが作られてトマトに蓄積されるのです。GABAトマトでは、実際に通常の4〜5倍のGABAを含んでいることがわかっています。2020年に届け出が厚生労働省に受理され、「シシリアンルージュハイギャバ」という名称で、国内で販売され始めています。
ゲノム編集技術によって作られ、厚生労働省や農林水産省への届け出が受理されたもう一つの例として、「ゲノム編集マダイ」があげられます。ゲノム編集マダイでは、筋肉の増殖を抑制する働きがあるミオスタチンと呼ばれる遺伝子が働かないようになっており、その結果、筋肉の増殖が促進するために食べられる部分が増量しています。通常の飼料で効率よく肉厚の可食部を得られるため、養殖魚として望ましい形質を有しているといえます。上述のGABAトマトと同様に、ゲノム編集マダイでも遺伝子の一部がゲノム編集技術によって欠損させられていますが、外来性の遺伝子を組み込んだものではないため「遺伝子組換え生物」とは異なります。
このようなゲノム編集を応用した食品は、これからもいろいろ開発されてくるものと考えられます。従来の品種改良と比べて「望んだ形質をもつ品種を短時間で作れる」ことがゲノム編集による品種改良の大きな利点です。これらのゲノム編集で導入される遺伝子変異は、自然界で発生しうる変異と基本的に違いはなく、従来の育種技術で得られるものと同等であると考えられていますが、余計な編集が生じていないことなども含めて安全性にも十分考慮した後に届け出が行われています。
創薬開発への応用
ゲノム編集は、創薬研究(薬を創るための基礎研究)の分野においても大きく期待されています。一般的に、ある疾患を対象とした薬を創るためには、その薬の安全性や有効性を確認するための動物実験を新薬開発の初期段階で実施する必要があります。例えば、疾患の病態を正確に再現した疾患モデル動物に対して、膨大な数に上る新薬候補化合物を投与することにより、有効性と安全性を示す化合物(薬物)の候補が選び出されます。しかしながら、ヒトと動物の種差が要因となって、疾患モデル動物がヒトの病態を反映していない場合があります。例えば、実際にはヒトで効果のない薬物が誤って動物では効果ありと判断され、臨床試験が行われてしまう恐れがあります。このようなことは、新薬開発の最終段階であるヒトでの検証段階(臨床試験)においてドロップアウトすることにつながり、それまでに費やした多額の研究開発費用や多くの時間・労力を無駄にすることになってしまうため、最も避けたいことの一つであります。
そこで、最近ではゲノム編集技術と人工多能性幹細胞(iPS細胞)技術を用いた創薬研究に注目が集まっています。なぜなら、ヒトiPS細胞を取り巻く技術開発の進展も伴って、現在ではヒトiPS細胞で効率良くゲノム編集を行うことが可能となっているからです。加えて、ヒトiPS細胞はあらゆる種類の細胞に分化することも可能であるため、ヒトiPS細胞に疾患の原因となる遺伝子変異をゲノム編集技術により導入した後、分化誘導することにより、結果的にヒト細胞由来のさまざまな疾患モデル細胞を人為的に作製することができるようになります。つまり、ゲノム編集技術によってヒトiPS細胞から作製されたヒト疾患モデル細胞は、疾患モデル動物よりもヒトの病態を培養皿上で忠実に再現することができるため、新しい治療薬の開発のための非常に魅力的な創薬ツールとなるだけでなく、これまで病因の解析が難しかった希少疾患などの病態解析においても非常に有用な病態モデルツールになり得ると期待されています。